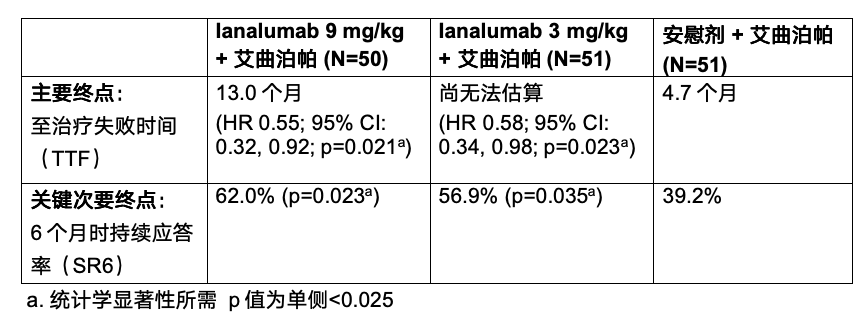
諾華12月9日宣布VAYHIT2三期臨床試驗取得積極結果,該試驗評估了ianalumab聯合艾曲泊帕在既往接受糖皮質激素治療的原發性免疫性血小板減少癥(ITP)患者中的療效和安全性。Ianalumab(9 mg/kg)聯合艾曲泊帕將ITP疾病控制延長了45%,該結果基于主要研究終點“至治療失敗時間(TTF, Time To Treatment Failure)”,即評估患者在治療期間及治療后維持安全血小板水平的時間。接受ianalumab聯合艾曲泊帕治療的患者,其至治療失敗的中位時間是安慰劑聯合艾曲泊帕組的2.8倍(13.0個月 vs 4.7個月)。
詳細數據于第67屆美國血液學會年會(ASH)的最新突破摘要(Late-Breaking Abstracts) 專場公布,并同步發表于《新英格蘭醫學雜志》。
“ITP的治療一直以來側重于提升血小板計數,通常需要長期治療以控制疾病。這意味著許多患者需要長期用藥,持續承受疾病負擔和如疲勞等的癥狀。”麻總百瀚醫院(Mass General Brigham)血液學/腫瘤學Peggy S. Blitz講席教授、哈佛醫學院醫學副教授Hanny Al-Samkari博士表示,“VAYHIT2試驗結果令人鼓舞,顯示即使在患者停藥期間也能實現更好的疾病控制,為ITP患者帶來新的希望。”
接受ianalumab(9 mg/kg)聯合艾曲泊帕治療的患者,在第6個月時持續血小板計數改善的比例也顯著高于安慰劑聯合艾曲泊帕治療組(62% vs 39%),達到了關鍵次要終點。疲勞改善方面,PROMIS疲勞評分顯示,ianalumab聯合艾曲泊帕組平均下降7.7分,安慰劑聯合艾曲泊帕治療組下降3.6分。
“B細胞驅動的自身免疫反應導致ITP患者血小板破壞和出血風險增加。Ianalumab的創新雙重作用機制旨在清除B細胞并阻斷其存活信號。”諾華全球腫瘤開發負責人Mark Rutstein博士表示,“憑借我們在ITP領域多年的經驗,VAYHIT2結果進一步證明ianalumab有望通過每月一次、共四次的靜脈輸注方案,實現持久疾病控制,讓患者無需長期持續治療。”
VAYHIT2評估了兩種劑量的ianalumab,其中9 mg/kg劑量在主要和關鍵次要終點均顯示出統計學顯著改善,3 mg/kg劑量在主要終點達到統計學顯著,關鍵次要終點有數值改善。
Ianalumab耐受性良好,未發現新的安全信號,安全性與既往研究一致。Ianalumab組與安慰劑組的不良事件發生率相當,最常見的不良事件為頭痛(9 mg/kg組14%,3 mg/kg組10%,安慰劑組8%)和輸注相關反應(9 mg/kg組14%,3 mg/kg組8%,安慰劑組8%)。中性粒細胞減少癥在ianalumab組更常見(9 mg/kg組16%,3 mg/kg組12%,安慰劑組2%),大多數病例無需治療或劑量調整即可恢復。未有因治療期間不良事件導致永久停藥的情況。
VAYHIT2是ianalumab的第三項獲得陽性結果的III期臨床試驗,此前在活動性干燥綜合征成人患者中已有兩項陽性結果。諾華計劃于2027年將VAYHIT2數據與正在進行的一線ITP試驗結果(VAYHIT1)一同提交。Ianalumab已獲得美國食品藥品監督管理局(FDA)和歐洲藥品管理局(EMA)的孤兒藥資格認定。(來源:諾華中國)
(注: 此文屬于央廣網登載的商業信息,文章內容不代表本網觀點,僅供參考。)
 長按二維碼
長按二維碼關注精彩內容






